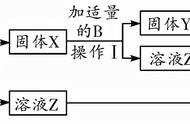
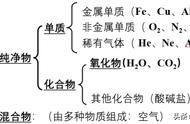
一、气体的实验室制法和工业制法
1.过氧化氢溶液与二氧化锰混合: (二氧化锰起 作用)
2.加热氯酸钾与二氧化锰混合物: (加热一段时间才产生O2)
3.加热高锰酸钾: (要在试管口塞 )
4.实验室用 和 制取CO2 :
(现象:产生大量 气泡 ,固体逐渐 溶解 。所制得的CO2会带来的杂质气体除了水蒸气,还有 )
5.实验室用锌粒和稀硫酸制氢气: (现象:产生大量 气泡 ,固体逐渐 溶解 )
6.工业高温煅烧大理石制取:CO2 (《石灰吟》所包含的反应)
二、物质的燃烧(物质与氧气的反应)
7.红磷在空气中燃烧: (现象:发光,生成 白烟,不能说白雾或烟雾)
8.硫燃烧:S+O2 点燃 SO2 (现象:在空气中 色火焰,在氧气中 色火焰,生成 剌激性 气味的气体)
9.铁丝在氧气中燃烧: (现象:火星四射,剧烈燃烧,生成 色固体。)
10.镁条燃烧: 2Mg+O2 点燃 2MgO (现象:发出耀眼的 白光 ,有白烟产生,生成 白 色固体)
11.铝在氧气中燃烧: (铝在常温下也和O2反应,形成致密的 )
12.铜在空气中加热: (紫红色的固体变 色)
13.木炭不充分燃烧: 2C+O2 点燃 2CO (当碳和氧气质量比为28:32,即3:4时,只生成CO)
14.木炭氧气中充分燃烧: C+O2 点燃 CO2 (现象:发出 光。当碳和氧气质量比为3:8时,只生成CO2) 15.CO的燃烧: (现象:产生 色火焰,CO作为尾气时可以用燃着的酒精灯烧掉)
16.氢气燃烧(爆炸): (现象:产生 色火焰,罩在火焰上方干冷烧杯内壁有水雾 )
17.甲烷的燃烧(天然气): (现象:产生 色火焰。)
18.乙醇的燃烧: (乙醇俗称 ,是可再生能源)
三、还原反应(三大还原剂是 C、CO、H2 ,它们具有 性,在反应中发生氧化反应)
19.木炭还原氧化铜: (现象: 色的固体变成 红色 ,澄清石灰水变 浑浊 )
20.木炭还原氧化铁:
21.CO还原氧化铜: (先通一会CO,才加热,防止加热CO与空气混合气,可能爆炸)
22.CO还原氧化铁: (现象: 色的固体变成 色 ,澄清石灰水变浑浊)
23.CO还原四氧化三铁: (此反应属于置换反应吗? )
24.氢气还原氧化铜: H2 CuO ∆ Cu+H2O (现象:黑色的固体变成 红色 ,试管内壁有 )
25.氢气还原氧化铁: 3H2 Fe2O3 ∆ 2Fe 3H2O(现象: 红 色的固体变成 黑色 ,试管内壁有 水雾 )
26.木炭还原CO2: C CO2 高温 2CO (此反应 热量,记住是CO2转化为CO的方法)
四、金属与溶液的反应(均属于 置换 反应,掌握反应的规律)
27.锌与稀盐酸: Zn+2HCl═ZnCl2+H2 ↑ (现象:固体逐渐 溶解 ,产生 气泡。)
28.镁与稀硫酸: Mg H2SO4 ═MgSO4 H2↑ (现象:固体逐渐 溶解 ,产生 气泡。反应放热明显)
29.镁与稀盐酸: Mg 2HCl ═MgCl2 H2↑ (现象:固体逐渐 溶解 ,产生 气泡。反应放热明显)
30.铁和稀硫酸: (所得溶液呈 色)
31.铁和稀盐酸:
32.铝和稀硫酸: (现象:固体逐渐 溶解 ,产生 气泡 。)
33.铝和稀盐酸: 2Al+6HCl═2AlCl3+3H2↑ (现象:固体逐渐 溶解 ,产生 气泡 。)
34.铜片投入硝酸银溶液中: (铜表面出现 色固体,溶液由无色变 色)
35.铁钉投入硫酸铜溶液中: Fe+CuSO4═FeSO4+Cu (铁表面出现 色固体,溶液由 色变 色)
36.铝片投入硫酸铜溶液中: (铝表面出现色固体,溶液由色变 色)
37.铝片投入硝酸银溶液中: Al+3AgNO3═Al(NO3)3 3Ag
五、氧化物、酸、碱、盐之间的反应(掌握反应的规律)
(1)某些非金属氧化物 碱═盐 水
38.氢氧化钠溶液变质:
39.检验二氧化碳(或石灰水变质的反应): (生成 色沉淀)
40.石灰浆吸收二氧化硫: (石灰水浓度太低,用石灰浆吸收效果好)
(2)金属氧化物 酸═盐 水(属于 反应)
41.稀硫酸溶解氧化铜: (固体逐渐溶解,所得溶液呈 色)
42.硫酸除铁锈: (固体逐渐溶解,所得溶液呈黄色)
43.盐酸和铝表面的氧化膜反应: (氧化膜反应完,内层的铝再反应,放出H2)
(2)酸、碱、盐之间的复分解反应(两种化合物互相交换成分,生成物中有沉淀或气体或水)
44.盐酸中和氢氧化钠:HCl NaOH═NaCl H2O (借助 溶液,溶液由 红色 变 证明中和反应发生)
45.熟石灰处理硫酸厂废水: (不能用氢氧化钠,碱性强,成本高)
46.氨水中和过多的硫酸: H2SO4 2NH3·H2O ═ (NH4)2SO4 2H2O (氨水中含有NH4 和OH-)
47.向纯碱中加入盐酸: (反应速率太快,不适宜用于实验室制CO2)
48.向小苏打加入盐酸:
49.盐酸与硝酸银的反应:HCl AgNO3═ AgCl↓ HNO3 (产生的沉淀是否溶于酸? )
50.由纯碱和石灰水制取烧碱: (CaCO3→CaO→ Ca(OH)2→NaOH)
51.氯化铁溶液中滴加氢氧化钠溶液 (产生 色 的沉淀)
52.硫酸铜溶液中滴加氢氧化钠溶液:CuSO4 2NaOH ═ Cu(OH)2↓ Na2SO4(产生 色 的沉淀)
53.氯化铵与氢氧化钙反应: (产生有刺激性的氨味)
54.硫酸铵与氢氧化钠反应:2NaOH+ (NH4)2SO4═ Na2SO4+2NH3↑+2H2O(产生有刺激性的氨味)
55.硫酸钠溶液与氯化钡溶液混合: (产生的沉淀是否溶于酸? )
六、要掌握的其它反应
56.正常雨水呈酸性的原因: 将CO2通入到紫色石蕊溶液中,溶液变 色)
57 .碳酸不稳定分解: H2CO3 ═ CO2↑ H2O (将通了CO2的石蕊溶液加热,溶液由 红 色变回 紫 色)
58.水通电分解: (负极放出 ,正极放出 ,体积比为 ,质量比是 )
59.生石灰(CaO)与水反应:CaO H2O ═ Ca(OH)2(此反应 热量。记住是由CaO制备Ca(OH)2的方法)
60.加热碳酸氢钠生成碳酸钠和两种氧化物: 2NaHCO3∆ Na2CO3 H2O CO2↑
图片
2021中考回归基础之化学方程式 答案版
一、气体的实验室制法和工业制法
1.过氧化氢溶液与二氧化锰混合: 2H2O2 MnO2 2H2O+O2 ↑ (二氧化锰起 催化 作用)
图片
2.加热氯酸钾与二氧化锰混合物: 2KClO3 MnO2 2KCl+3O2↑ (加热一段时间才产生O2)
3.加热高锰酸钾: 2KMnO4 ∆ K2MnO4+MnO2+O2↑(加热一段时间才产生O2, 在试管口塞一团棉花)
4.实验室用 大理石或石灰石 和 稀盐酸 制取CO2 : CaCO3 2HCl ═ CaCl2 H2O CO2↑ (HCl≠稀盐酸)
(现象:产生大量 气泡 ,固体逐渐 溶解 。所制得的CO2会带来的杂质气体除了水蒸气,还有 HCl )
5.实验室用锌粒和稀硫酸制氢气: Zn+H2SO4═ZnSO4+H2 ↑ (现象:产生大量 气泡 ,固体逐渐 溶解 )
6.工业高温煅烧大理石制取:CO2 CaCO3 高温 CaO CO2↑ (《石灰吟》所包含的反应,千锤万凿…,烈火焚烧…)
二、物质的燃烧(物质与氧气的反应)
7.红磷在空气中燃烧: 4P+5O2 点燃 2P2O5 (现象:发光,生成 白烟,不能说白雾或烟雾)
8.硫燃烧:S+O2 点燃 SO2 (现象:在空气中 淡蓝 色火焰,在氧气中 蓝紫 色火焰,生成 剌激性 气味的气体)
9.铁丝在氧气中燃烧:3Fe+2O2 点燃 Fe3O4(现象:火星四射,剧烈燃烧,生成 黑 色固体。集气瓶底留水或沙)
10.镁条燃烧: 2Mg+O2 点燃 2MgO (现象:发出耀眼的 白光 ,有白烟产生,生成 白 色固体)
11.铝在氧气中燃烧: 4Al 3O2 点燃 2Al2O3 (铝在常温下也和O2反应,形成致密的 氧化铝保护膜 )
12.铜在空气中加热: 2Cu O2 ∆ 2CuO (紫红色的固体变 黑 色)
13.木炭不充分燃烧: 2C+O2 点燃 2CO (当碳和氧气质量比为28:32,即3:4时,只生成CO)
14.木炭氧气中充分燃烧: C+O2 点燃 CO2 (现象:发出 白 光。当碳和氧气质量比为3:8时,只生成CO2)
15.CO的燃烧: 2CO+O2 点燃 2CO2 (现象:产生蓝色火焰,CO作为尾气时可以用燃着的酒精灯烧掉)
16.氢气燃烧(爆炸): 2H2+O2 点燃 2H2O(现象:产生淡蓝色火焰,罩在火焰上方干冷烧杯内壁有水雾 )
17.甲烷的燃烧(天然气):CH4+2O2 点燃 CO2+2H2O (现象:产生 蓝 色火焰。天然气是化石燃料中最清洁的)
18.乙醇的燃烧: C2H5OH+3O2 点燃 2CO2+3H2O (乙醇俗称 酒精 ,是可再生能源,乙醇汽油是混合物)
三、还原反应(三大还原剂是 C、CO、H2 ,它们具有 还原性 ,在反应中发生氧化反应)
19.木炭还原氧化铜: C+2CuO 高温 2Cu+CO2↑ (现象:黑 色的固体变成 红色 ,澄清石灰水变 浑浊 )
20.木炭还原氧化铁: 3C+2Fe2O3 高温 4Fe+3CO2↑ (现象: 红 色的固体变成 黑色 ,澄清石灰水变浑浊)
21.CO还原氧化铜:CO+CuO∆ Cu+CO2 (先通一会CO,才加热,防止加热CO与空气混合气,可能爆炸)
22.CO还原氧化铁: Fe2O3+3CO 高温 2Fe+3CO2 (现象: 红 色的固体变成 黑色 ,澄清石灰水变浑浊)
23.CO还原四氧化三铁: Fe3O4+4CO 高温 3Fe+4CO2(此反应属于置换反应吗? 不属于 )
24.氢气还原氧化铜: H2 CuO ∆ Cu+H2O (现象:黑色的固体变成 红色 ,试管内壁有 水雾 )
25.氢气还原氧化铁: 3H2 Fe2O3 ∆ 2Fe 3H2O(现象: 红 色的固体变成 黑色 ,试管内壁有 水雾 )
26.木炭还原CO2: C CO2 高温 2CO (此反应 吸收 热量,记住是CO2转化为CO的方法)
四、金属与溶液的反应(均属于 置换 反应,掌握反应的规律)
27.锌与稀盐酸: Zn+2HCl═ZnCl2+H2 ↑ (现象:固体逐渐 溶解 ,产生 气泡。)
28.镁与稀硫酸: Mg H2SO4 ═MgSO4 H2↑ (现象:固体逐渐 溶解 ,产生 气泡。反应放热明显)
29.镁与稀盐酸: Mg 2HCl ═MgCl2 H2↑ (现象:固体逐渐 溶解 ,产生 气泡。反应放热明显)
30.铁和稀硫酸: Fe+H2SO4 ═FeSO4+H2↑ (所得溶液呈 浅绿 色,因为含有Fe2 )
31.铁和稀盐酸: Fe 2HCl ═ FeCl2 H2↑ (所得溶液呈 浅绿 色,因为含有Fe2 )
32.铝和稀硫酸: 2Al+3H2SO4 ═Al2(SO4)3+3H2↑(现象:固体逐渐 溶解 ,产生 气泡 。)
33.铝和稀盐酸: 2Al+6HCl═2AlCl3+3H2↑ (现象:固体逐渐 溶解 ,产生 气泡 。)
34.铜片投入硝酸银溶液中: Cu+2AgNO3═2Ag+Cu(NO3)2 (铜表面出现银白色固体,溶液由无色变蓝 色)
35.铁钉投入硫酸铜溶液中: Fe+CuSO4═FeSO4+Cu (铁表面出现 红 色固体,溶液由 蓝 色变 浅绿 色)
36.铝片投入硫酸铜溶液中: 2Al+3CuSO4═3Cu+Al2(SO4)3 (铝表面出现 红 色固体,溶液由 蓝 色变无色)
37.铝片投入硝酸银溶液中: Al+3AgNO3═Al(NO3)3 3Ag
五、氧化物、酸、碱、盐之间的反应(掌握反应的规律)
(1)某些非金属氧化物 碱═盐 水(是否属于基本反应类型 不属于 )
38.氢氧化钠溶液变质:2NaOH CO2 ═ Na2CO3 H2O(是否属复分解反应 否 )
39.检验二氧化碳(或石灰水变质的反应): CO2 Ca(OH)2═CaCO3↓ H2O (生成 白 色沉淀)
40.石灰浆吸收二氧化硫:SO2 Ca(OH)2═CaSO3 H2O (石灰水浓度太低,用石灰浆吸收效果好)
(2)金属氧化物 酸═盐 水(属于 复分解 反应)
41.稀硫酸溶解氧化铜:CuO H2SO4 ═ CuSO4 H2O (固体逐渐溶解,所得溶液呈 蓝 色)
42.硫酸除铁锈: Fe2O3 3H2SO4═ Fe2(SO4)3 3H2O (固体逐渐溶解,所得溶液呈黄色)
43.盐酸和铝表面的氧化膜反应:Al2O3 6HCl═2AlCl3 3H2O (氧化膜反应完,内层的铝再反应,放出H2)
(2)酸、碱、盐之间的复分解反应(两种化合物互相交换成分,生成物中有沉淀或气体或水)
44.盐酸中和氢氧化钠:HCl NaOH═NaCl H2O (借助 酚酞 溶液,溶液由 红色 变 无色 证明中和反应发生)
45.熟石灰处理硫酸厂废水:H2SO4 Ca(OH)2 ═ CaSO4 2H2O (不能用氢氧化钠,碱性强,成本高)
46.氨水中和过多的硫酸: H2SO4 2NH3·H2O ═ (NH4)2SO4 2H2O (氨水中含有NH4 和OH-)
47.向纯碱中加入盐酸: Na2CO3 2HCl ═ 2NaCl H2O CO2↑ (反应速率太快,不适宜用于实验室制CO2)
48.向小苏打加入盐酸: NaHCO3 HCl ═ NaCl H2O CO2↑
49.盐酸与硝酸银的反应:HCl AgNO3═ AgCl↓ HNO3 (产生的沉淀是否溶于酸? 不溶 )
50.由纯碱和石灰水制取烧碱:Ca(OH)2 Na2CO3 ═ CaCO3↓ 2NaOH (CaCO3→CaO→ Ca(OH)2→NaOH)
51.氯化铁溶液中滴加氢氧化钠溶液:3NaOH FeCl3 ═ Fe(OH)3↓ 3NaCl(产生 红褐色 的沉淀)
52.硫酸铜溶液中滴加氢氧化钠溶液:CuSO4 2NaOH ═ Cu(OH)2↓ Na2SO4(产生蓝色的沉淀)
53.氯化铵与氢氧化钙反应: Ca(OH)2+2NH4Cl═ CaCl2+2NH3↑+2H2O (产生有刺激性的氨味)
54.硫酸铵与氢氧化钠反应:2NaOH+ (NH4)2SO4═ Na2SO4+2NH3↑+2H2O(产生有刺激性的氨味)
55.硫酸钠溶液与氯化钡溶液混合:Na2SO4 BaCl2═ BaSO4↓ 2NaCl (产生的沉淀是否溶于酸? 不溶 )
六、要掌握的其它反应
56.正常雨水呈酸性的原因: CO2 H2O ═ H2CO3 (将CO2通入到紫色石蕊溶液中,溶液变 红 色)
57 .碳酸不稳定分解: H2CO3 ═ CO2↑ H2O (将通了CO2的石蕊溶液加热,溶液由 红 色变回 紫 色)
58.水通电分解: 2H2O 通电 2H2↑+O2 ↑ (负极放出 H2 ,正极放出 O2 ,体积比为 2:1 ,质量比是 1:8 )
59.生石灰(CaO)与水反应:CaO H2O ═ Ca(OH)2(此反应 放出 热量。记住是由CaO制备Ca(OH)2的方法)
60.加热碳酸氢钠生成碳酸钠和两种氧化物: 2NaHCO3∆ Na2CO3 H2O CO2↑
欢迎关注*中学高分宝典