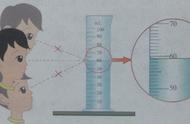
(1)甲同学用图A所示实验:在瓶中先铺一层细沙,再引燃白磷,为什么?__防止锥形瓶底部炸裂__。此实验中气球的主要作用是__缓冲作用__,实验过程中产生的现象是__白磷燃烧产生白烟,气球先变大后变小,天平仍然平衡(2分)__。
(2)乙同学用B装置研究质量守恒定律时,一段时间后发现天平的指针偏右。造成天平的指针向右偏转的原因是__产生的二氧化碳气体逸散到空气中__。
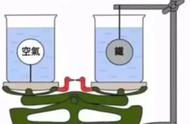
(3)丙同学用C实验说明了质量守恒定律,C实验能在敞口容器中进行实验的原因__没有气体参加反应,反应过程也没有气体生成(2分)__。
(4)丁同学用图D中的镁带在空气中燃烧的实验来探究质量守恒定律时,发现一定质量的镁完全燃烧后留下的固体质量比反应前镁带的质量轻,联系实验现象,可能的原因是__一部分氧化镁逸散到空气中__,如果在燃着的镁条上方罩上罩,使生成物全部收集起来称量,出现的结果是__偏大__(选填"偏大""偏小"或"不变")。
(5)综上所述,A、B、C、D所示四个实验中能用质量守恒定律解释的是实验__ABCD__(选填字母序号,下同);上述现象能用来验证质量守恒定律的是实验__AC__。
23.(10分)某化学小组同学用如图所示实验探究质量守恒定律。

(1)充分反应冷却后,天平仍然平衡的是__A__(填字母),该反应的化学方程式为__4P+5O22P2O5__。
(2)由上述实验可知,在化学反应前后,一定不变的是__①②⑤⑥__。
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质总质量。
(3)红热的铁能与水蒸气反应,放出气体X,同时生成固体Y。X气体靠近火焰点火时,能燃烧或发出爆鸣声。其反应的化学方程式为3Fe+4H2O4X+Y,则X的化学式为__H2__,Y的化学式为__Fe3O4__。
五、计算题(本大题包括1小题,共10分)
24.石灰石中含有的碳酸钙是重要的工业原料,为了测定某地石灰石中碳酸钙的含量,取石灰石样品25.0 g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(假设杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
已知:CaCO3+2HCl===CaCl2+H2O+CO2↑
计算:
(1)当加入盐酸的总质量为50.0 g时,充分反应后生成的气体质量是__4.4__g__。
(2)m=__93.4__。
(3)该石灰石样品中碳酸钙的质量分数。
解:设石灰石样品中CaCO3的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 8.8 g
= x=20 g
石灰石样品中CaCO3的质量分数×100%=80%
答:该石灰石样品中CaCO3的质量分数为80%。
,