自从学习了元素周期表,杂乱无章的元素就有了规律,但是也有很多物质的性质不按套路出牌,李老师给大家整理了50条特殊性质,供大家参考。
1.原子都是由质子、中子和电子组成,但氢的同位素氕却无中子。
2.同周期的元素中,原子最外层电子越少,越容易失去电子,还原性越强,但Cu、Ag原子的还原性却很弱。
3.原子电子层数多的其半径大于电子层数少的,但锂的原子半径大于铝的原子半径。
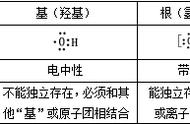
4.胶体中的胶粒一般都带电荷,但蛋白质胶体微粒却不带电荷(呈电中性,但有电泳现象)。
5.同主族元素的非金属元素随原子序数的递增,其最高价氧化物的水化物的酸性逐渐减弱,但硒酸的酸性却比硫酸的酸性强。
6.二氧化碳通常能来灭火,但镁却能与它燃烧。
7.氧元素一般显-2价,但在Na2O2、H2O2等物质中显-1价。
8.元素的氧化性一般随化合价的升高而增强,但氯的含氧酸的氧化性顺序却是HC1O 〉HC1O2 〉HC1O3 〉HC1O4。
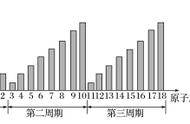
9.在元素周期表中的各周期元素一般是以活泼金属开始的,第一周期却是以非金属开始的。
10.通常金属单质一般为固态,但汞却是液态。

11.通常非金属单质一般为气态或固态,但溴却是液态。
12.碱金属一般保存在煤油中,但锂(因其密度小于煤油的密度)却浸在液体石蜡中。
13.碱金属的密度从上到下递增,但钾的密度却比钠的密度小。
14.一种元素组成一种单质,但碳、氢、氧、磷等元素却能分别组成几种同素异形体。
15.金属单质的导电性一般随温度的升高而减弱,但锑、锗却相反。
16.具有金属光泽又能导电的单质是金属,但石墨却是非金属。
17.有机物一般易燃烧,但四氯化碳和聚四氟乙烯却不易燃。
18.物质的熔点一般低于沸点,但乙炔却相反(沸点-84,熔点却为-80.8)。
19.C12、Br2与水反应生成相应的氢卤酸和次卤酸,但F2却不能(F2 2H2O=4HF O2)。
20.卤素单质与强碱反应一般生成相应的卤化物、次卤酸盐和水,但F2却不能(X2 NaOH = NaX NaXO H2O,2F2 2NaOH = 2NaF OF2 H2O)。
21.实验室中制取HC1、HBr、HI都在玻璃容器中进行,但HF应在铅制容器中进行(因SiO2 4HF = SiF4 2H2O)。

22.氢卤酸一般是强酸,但氢氟酸却是弱酸。
23.CaC12、CaBr2、CaI2都易溶,但CaF2却微溶。
24.卤化银难溶于水,但氟化银却易溶于水。
25.含有NH4 和第IA主族阳离子的盐一般易溶于水,但KC1O4和正长石等却难溶于水。
26.重金属阳离子一般都有毒,但BaSO4却可用作“钡餐”。
27.成网状结构的晶体一般都是原子晶体,但石墨却是原子晶体。
28.晶体一般都由阴离子和阳离子组成,但金属晶体是由金属阳离子和自由电子组成。
29.共价键一般都有方向性,但H2却无方向性。
30.有机物一般为分子晶体,且熔沸点低,但醋酸钠、醋酸钙等却为离子晶体,且熔沸点高。

31.活泼金属与活泼非金属形成的化合物一般都是离子化合物,但A1C13、BrC13等却是共价化合物。
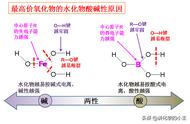
32.金属性强的元素,相应的碱的碱性也强,但A1(OH)3 的碱性却比Fe(OH)3 弱。
33.离子化合物中一般不存在单个分子,但NaC1等在气态时却以分子形式存在。
34.离子方程式一般表示同一类反应,但Br2 SO2 2H2O = 4H 2Br- SO42- 却只表示一个方程式(注意:Ba2 2OH - 2H SO42- = BaSO4 2H2O 可以表示硫酸溶液与氢氧化钡溶液反应、向氢氧化钡溶液中加入硫酸氢钠溶液至中性或加入过量 硫酸氢钠溶液等反应)。
35.强碱弱酸盐或强碱弱酸的酸式盐因水解而呈碱性,但NaH2PO4却呈酸性。
36.盐类一般都是强电解质,但HgC12、CdI2 等少数几种盐却是弱电解质。
37.酸碱中和生成盐和水,但10HNO3 3Fe(OH)2 =3Fe(NO3)3 NO 8H2O 中还有还原产物。
38.在金属活动性顺序表里,排在氢前面的金属能置换出酸中的氢,但铅却不能与硫酸反应放出氢气。
39.在金属活动性顺序表里,排在氢后面的金属不能置换出酸中的氢,但铜却能与浓盐酸反应产生氢气,2C u 4HC1(浓)=H2 2H[CuC12]。

40.在金属活动性顺序表里,排在前面的金属能把排在后面的金属从其盐溶液中置换出来,但钾钙钠却不能[2Na CuSO4 2H2O = Cu(OH)2 Na2SO4 H2 ]。
41.在金属活动性顺序表里,排在前面的金属不能把排在后面的金属从其不溶于水的盐中置换出来,但铁却能把银从氯化银中置换出来 (Fe 2AgC1=FeC12 2A g)。
42.一般只能用强酸制弱酸,但 H2S CuSO4 = CuS H2SO4、HC1O H2SO3 =HC1 H2SO4、Br2 H2SO3 = 2HBr H2SO4(C12、FeC13等也可以)等反应却能用弱酸制强酸。
43.酸能与醇发生酯化反应,但氢卤酸与醇发生卤代反应。
44.制取氯气采用固—液装置,但制溴却须采用曲颈甑。
45.启普发生器适用于反应物为块状、反应不需加热以及产物难溶于反应液的气体(如 H2、CO2、H2S),但乙炔(C2H2)却不能用该装置。
46.测量仪器的“0”刻度不是在上就是在下,但是托盘天平的指针却在中间,温度计的“0”刻度在偏中下,量筒无“0”刻度。
47.一般只有有机物才有同分构现象,但不少无机物如氰酸银(AgCNO)与雷酸银 (AgONC)是互为同分异构体。
48.固体物质的溶解度一般随温度找升高而增大,NaC1的溶解度受温度改变的影响很小,而Ca(OH)2、Li 2CO3等却随温度的升高而降低。
49.氯化钙是中性干燥剂,可用来干燥酸性、中性、碱性气体,但不能干燥氨气(CaC12·8NH3)和酒精蒸气。
50.非金属的气态氢化物的水溶液一般呈酸性,但NH3的水溶液却呈碱性。
我是欢迎关注我的头条号,持续分享教育内容,点开我的主页一定有你感兴趣的内容。