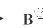CuO H2O
②插入铁片或锌片,在金属片上有红色的铜析出。
Cu2 Fe=Fe2 Cu
③加入浓氨水,生成的蓝色沉淀,溶于过量浓氨水中,呈深蓝色溶液。
Cu2+ 2NH3·H2O=Cu(OH)2↓ 2NH4+
Cu(OH)2 4NH3·H2O=[Cu(NH3)4]2+ 2OH- 4H2O
④加入H2S溶液,产生黑色沉淀。
Cu2+ H2S= CuS↓ 2H
9. Fe2 (浅绿色)
①加入少量NaOH溶液,生成白色沉淀Fe(OH)2,迅速变成灰绿色,最终变成红褐色Fe(OH)3。
Fe2 2OH- = Fe(OH)2↓
4Fe(OH)2 O2 2H2O=4Fe(OH)3
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
2Fe2 Cl2 =2Fe3 2Cl-
Fe3 3SCN-=Fe(SCN)3 (血红色溶液)
10. Fe3 (黄色)
①加入KSCN溶液,变为血红色Fe(SCN)3溶液。
Fe3 3SCN- = Fe(SCN)3 (血红色溶液)
②加入NaOH溶液,生成红褐色Fe(OH)3沉淀。
Fe3 3OH- = Fe(OH)3↓
③加入淀粉KI溶液,溶液显蓝色。
2Fe3 2I-=2Fe2 I2
④取少量待测溶液于试管中,加入苯酚,溶液显紫色。
11. Ca2
取少量待测溶液于试管中,加入Na2CO3溶液,产生白色沉淀,再向沉淀中加入稀盐酸,沉淀溶于稀盐酸中。
Ca2+ CO32-=CaCO3↓
CaCO3 2H+=Ca2+ CO2↑ H2O
阴离子
1. OH-
①取样,滴加紫色石蕊试液,变蓝。
②取样,滴加无色酚酞,变红。
③取样,滴加橙色的甲基橙,变黄。
④用玻璃棒蘸取少量待测液滴到干燥的pH试纸上,pH>7。
⑤用玻璃棒蘸取少量待测液滴到红色石蕊试纸上,试纸变蓝。
2.Cl-
取少量待测溶液于试管中,加入AgNO3溶液,再向沉淀中加入稀盐酸,生成不溶于稀硝酸或稀盐酸的白色沉淀(AgCl)。
Ag Cl- = AgCl↓
3.Br-
①取少量待测溶液于试管中,加入AgNO3溶液,再向沉淀中加入稀盐酸,生成不溶于稀硝酸或稀盐酸的淡黄色沉淀(AgBr)。
Ag Br- = AgBr↓
②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
Cl2 2Br- = 2Cl- Br2
4.I-
①取少量待测溶液于试管中,加入AgNO3溶液,再向沉淀中加入稀盐酸,生成不溶于稀硝酸或稀盐酸的黄色沉淀(AgI)。
Ag I- = AgI↓
②加入氯水和淀粉溶液,溶液变蓝。
Cl2 2I- = 2Cl- I2
5.SO42-
取少量待测溶液于试管中,加入BaCl2溶液,再向沉淀中加入稀盐酸,生成不溶于稀硝酸或稀盐酸的白色沉淀(BaSO4)。
Ba2 SO42- = BaSO4↓
6.SO32-
①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色(SO2有漂白性)。
SO32- 2H = SO2↑ H2O
②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。
Ba2 SO32- =BaSO3↓
SO32- 2H = SO2↑ H2O
7.S2-
①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑。
S2- 2H =H2S↑
Pb(CH3COO)2 H2S = PbS↓ 2CH3COOH
②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS)。
Pb2 S2-=PbS↓
Cu2 S2-=CuS↓
8.CO32-
①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊。
Ba2 CO32- =BaCO3↓
CO32- 2H = CO2↑ H2O
Ca2 2OH- CO2 = CaCO3↓ H2O
②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊。
CO32- 2H = CO2↑ H2O
Ca2 2OH- CO2 = CaCO3↓ H2O
9.HCO3-
加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊。
HCO3- H = CO2↑ H2O
Ca2 2OH- CO2 = CaCO3↓ H2O
10.NO3-
向被检物的浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2)。
Cu 4H+ 2NO3-

Cu2+ 2NO2↑ 2H2O
11.PO43-
取少量待测溶液于试管中,加入AgNO3溶液,产生黄色沉淀Ag(PO4)3,再向沉淀中加入稀硝酸,沉淀溶解。
Ag PO43-= Ag(PO4)3
Ag3PO4 3HNO3= 3AgNO3 H3PO4
常见的离子方程式

1、向氢氧化钠溶液中通入少量CO2 :
2NaOH CO2 =Na2CO3 H2O
CO2 OH-═CO32- H2O
2、在标准状况下2.24 L CO2通入1mol/L 100mL NaOH溶液中:
CO2 NaOH =NaHCO3
CO2 OH-═HCO3-
3、烧碱溶液中通入过量二氧化硫:
NaOH SO2=NaHSO3
OH- SO2═HSO3-
4、在澄清石灰水中通入过量二氧化碳:
Ca(OH)2 2CO2=Ca(HCO3)2
CO2 OH-═HCO3-
5、氨水中通入少量二氧化碳:
2NH3•H2O CO2=(NH4)2CO3 H2O
2NH3•H2O CO2═2NH4++2H2O
6、用碳酸钠溶液吸收少量二氧化硫:
Na2CO3 SO2=Na2SO3 CO2↑
CO32- SO2═SO32- CO2↑
7、二氧化碳通入碳酸钠溶液中:
Na2CO3 CO2 H2O=2NaHCO3
CO32- CO2 H2O═HCO3-
8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:
Pb(Ac)2 H2S=PbS↓ 2HAc
Pb(Ac)2 H2S═PbS↓ 2HAc
9、苯酚钠溶液中通入少量二氧化碳:
CO2 H2O C6H5ONa→C6H5OH NaHCO3
CO2 H2O C6H5O-→C6H5OH HCO3-
10、氯化铁溶液中通入碘化氢气体:
2FeCl3 2HI =2FeCl2 I2 2HCl
2Fe3+ 2H++2I-═2Fe2+ I2 2H+
11、硫酸铁的酸性溶液中通入足量硫化氢:
Fe2(SO4)3 H2S= 2FeSO4 S H2SO4
2Fe3+ H2S═2Fe2+ S↓ 2H+
12、少量SO2气体通入NaClO溶液中:
2NaClO 2SO2 2H2O=Na2SO4 2HCl H2SO4
2ClO- 2SO2 2H2O═SO42- 2Cl- 2H++SO42-
13、氯气通入水中:
Cl2 H2O ⇌ HCl HClO
Cl2 H2O ⇌ H++Cl- HClO
14、氟气通入水中:
2F2 2H2O=4HF O2↑
2F2 2H2O═4HF O2↑
15、氯气通入冷的氢氧化钠溶液中:
Cl2 2NaOH=NaClO NaCl H2O
Cl2 2OH-═Cl- ClO- H2O
16、FeBr2溶液中通入过量Cl2:
2FeBr2 3Cl2=2FeCl3 2Br2
2Fe2+ 4Br- 3Cl2═2Fe3+ 2Br2 +6Cl-
17、FeBr2溶液与等物质的量Cl2反应:
6FeBr2 6C12 = 4FeCl3 2FeBr3 3Br2
2Fe2+ 2Br- 2Cl2═2Fe3 Br2+4Cl-
18、足量氯气通入碘化亚铁溶液中:
3Cl2 2FeI2=2FeCl3 2I2
3Cl2 2Fe2++4I-═2Fe3+ 2I2
19、在FeI2溶液中滴入少量溴水:
FeI2 Br2=FeBr2 I2
Br2+2I-═2Br- I2
20、氯化亚铁溶液中滴入溴水:
6FeCl2 3Br2═4FeCl3 2FeBr3
2Fe2+ Br2═2Fe3++2Br-
21、钠与水反应:
2Na 2H2O=2NaOH H2↑
2Na 2H2O═2Na++2OH- H2↑
22、铝片投入氢氧化钠溶液:
2Al 2NaOH 2H2O2NaAlO2 3H2↑
2Al 2OH- 6H2O═2AlO2- 3H2↑
23、氯化铁溶液中加入铁粉:
2FeCl3 Fe =3FeCl2
2Fe3++Fe═3Fe2+
24、FeCl3溶液与Cu反应:
2FeCl3 Cu=CuCl2 2FeCl2
2Fe3++Cu═Cu2++2Fe2+
25、硫氢化钠溶液与碘反应:
NaHS I2=S↓ HI NaI
HS- I2═S↓ 2I-
26、过氧化钠和水反应:
2Na2O2 2H2O = 4NaOH O2↑
2Na2O2 2H2O═4Na++4OH- O2↑
27、铜与浓硝酸反应:
Cu 4HNO3(浓)=Cu(NO3)2 2NO2↑ 2H2O
Cu 4H++2NO3-═Cu2+ 2NO2↑ 2H2O
28、铜与稀硝酸反应:
3Cu 8HNO3(稀)=3Cu(NO3)2 2NO↑ 4H2O
3Cu 8H++2NO3-═3Cu2+ 2NO↑ 4H2O
29、稀硝酸除银镜:
3Ag 4HNO3=3AgNO3 NO↑ 2H2O
3Ag 4H++NO3-═3Ag+ NO↑ 2H2O
30、稀硝酸与过量的铁屑反应:
3Fe 8HNO3(稀)=3Fe(NO3)2 2NO↑ 4H2O
3Fe 8H 2NO3—═3Fe2 2NO↑ 4H2O
31、FeS和稀硝酸反应:
FeS 4HNO3═Fe(NO3)3 NO↑ S↓ 2H2O
FeS 4H++2NO3-═Fe3++NO↑ S↓ 2H2O
32、电解饱和食盐水:
2NaCl 2H2O=(电解)C12↑ H2↑ 2NaOH
2Cl- 2H2O=(电解)C12↑ H2↑ 2OH-
33、用石墨电极电解硫酸铜溶液:
2CuSO4 2H2O =(电解)O2↑ 2Cu 2H2SO4
2Cu2 +2H2O=(电解)2Cu+O2↑ 4H
34、醋酸加入氨水:
CH3COOH NH3·H2O=CH3COONH4 H2O
CH3COOH NH3·H2O=CH3COO-+NH4+ H2O
35、氢氧化镁加入醋酸:
Mg(OH)2 2CH3COOH=(CH3COO)2Mg 2H2O
Mg(OH)2 2CH3COOH═2CH3COO-+Mg2+ 2H2O
36、在硫酸铜溶液中加入过量氢氧化钡溶液:
CuSO4 Ba(OH)2═Cu(OH)2↓ BaSO4↓
Cu2++SO42- Ba2++2OH- ═Cu(OH)2↓ BaSO4↓
37、石灰乳与海水制取氢氧化镁:
MgCl2 Ca(OH)2═Mg(OH)2↓ CaCl2
Mg2++2OH-═Mg(OH)2↓
38、少量氢氧化钙溶液与碳酸氢钙溶液混合:
Ca(HCO3)2 Ca(OH)2=2CaCO3↓ 2H2O
Ca2++HCO3-+OH-═CaCO3↓ H2O
39、向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:
Ca(HCO3)2 2NaOH═CaCO3↓ Na2CO3 2 H2O
Ca2++2HCO3-+2OH-═CaCO3↓ H2O+CO32-
40、少量氢氧化钙溶液与碳酸氢钠溶液混合:
Ca(OH)2 2NaHCO3═CaCO3↓ Na2CO3 2H2O
Ca2++2HCO3-+2OH-═CaCO3↓ H2O+CO32-
41、碳酸氢镁溶液中加入过量的澄清石灰水:
Mg(HCO3)2 2Ca(OH)2═2CaCO3↓ Mg(OH)2↓ 2H2O
Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓ 2H2O
42、氢氧化钡溶液和碳酸氢镁溶液反应:
Mg(HCO3)2 Ba(OH)2=Mg(OH)2↓ BaCO3↓ 2H2O
Mg2++2HCO3-+Ba2++2OH-═Mg(OH)2↓ BaCO3↓ 2H2O
43、向碳酸氢镁溶液中加人过量氢氧化钠:
Mg(HCO3)2 4NaOH=Mg(OH)2↓ 2Na2CO3 2H2O
Mg2++2HCO3-+4OH-═Mg(OH)2↓+2H2O+CO32-
44、NH4HCO3溶液与过量的NaOH溶液反应:
NH4HCO3 2NaOH(过量)═Na2CO3 NH3↑ 2 H2O
NH4++HCO3-+2OH-═CO32-+2H2O+NH3↑
45、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全
NH4HSO4 Ba(OH)2═BaSO4↓ NH3·H2O H2O
NH4++H++SO42- Ba2++2OH-═BaSO4↓ NH3·H2O H2O
46、碳酸氢铵溶液中加入足量氢氧化钡溶液:
NH4HCO3 Ba(OH)2═BaCO3↓ NH3↑ 2H2O
NH4++HCO3-+Ba2++2OH-═BaCO3↓ NH3↑ 2H2O
47、在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:
NH4HSO3 2NaOH=Na2SO3 NH3·H2O H2O
NH4++HSO3-+OH-═SO32- NH3·H2O H2O
48、硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:
2NaHSO4 Ba(OH)2═Na2SO4 BaSO4↓ 2H2O
2H++SO42- Ba2++2OH-═BaSO4↓ 2H2O
49、硝酸铝溶液中加入过量氨水:
Al(NO3)3 3NH3·H2O= Al(OH)3↓ 3NH4NO3
Al3++3NH3·H2O═Al(OH)3↓ 3NH4+
50、明矾溶液中加入过量的氨水:
2KAl(SO4)2 6NH3·H2O=2Al(OH)3↓ K2SO4 3(NH4)2SO4
Al3++3NH3·H2O═Al(OH)3↓ 3NH4+
51、等物质的量浓度、等体积的氢氧化钡溶液与明矾溶液混合:
6Ba(OH)2 6KAl(SO4)2=6BaSO4↓ 3K2SO4 4Al(OH)3↓ Al2(SO4)3
3Ba2++6OH-+3Al3++3SO42-═3BaSO4↓ 2Al(OH)3↓
52、大理石与盐酸反应制CO2气体:
CaCO3 2HCl═2CaCl2 CO2↑ H2O
CaCO3 2H+═Ca2++CO2↑ H2O
53、碳酸钙中滴入醋酸溶液:
CaCO3 2CH3COOH=(CH3COO)2Ca CO2↑ H2O
CaCO3 2CH3COOH═2CH3COO-+Ca2+ CO2↑ H2O
54、乙酸溶液中加入少量碳酸氢铵溶液:
CH3COOH十NH4HCO3=CH3COONH4 CO2↑ H2O
CH3COOH十HCO3-═CH3COO-+CO2↑ H2O
55、硫化钠溶液中加入盐酸:
Na2S 2HCl=2NaCl H2S↑
S2- 2H+═H2S↑
56、碳酸氢钙溶液和盐酸反应:
Ca(HCO3)2 2HCl=CaCl2 2CO2↑ 2H2O
HCO3-+H+═CO2↑ H2O
57、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:
Na2CO3 HCl=NaCl NaHCO3
CO32-+H+═HCO3-
58、碳酸钠溶液中逐滴加入等物质的量的乙酸:
Na2CO3 CH3COOH= CH3COONa NaHCO3
CO32-+CH3COOH═CH3COO-+HCO3-
59、适量的稀硫酸滴入四羟基合铝酸钠溶液中:
2Na[Al(OH)4] H2SO4=2Al(OH)3↓ Na2SO4 2H2O
[Al(OH4]-+H+═Al(OH)3↓ H2O
60、硫酸铜溶液中加入氢硫酸:
CuSO4 H2S= CuS↓ H2SO4
Cu2+ H2S═CuS↓ 2H+
61、Na2CO3的水解:
Na2CO3 H2O⇌ NaHCO3 NaOH
CO32-+H2O⇌HCO3-+OH-
62、硫氢化钠的水解:
NaHS H2O ⇌ H2S NaOH
HS- H2O⇌H2S OH-
63、实验室制备氢氧化铁胶体:
FeCl3 3H2O

Fe(OH)3(胶体) 3HCl
Fe3++3H2O═Fe(OH)3(胶体) 3H+
64、氯化铝溶液中加足量碳酸氢钠溶液:
AlCl3 3NaHCO3=Al(OH)3↓ 3NaCl 3CO2↑
Al3++3HCO3-═Al(OH)3↓ 3CO2↑
65、硫酸亚铁溶液中加入过氧化氢溶液:
2FeSO4 H2O2 H2SO4═Fe2(SO4)3 2H2O
2Fe2++H2O2 2H+═2Fe3++2H2O
66、NaNO2溶液中加入酸性KMnO4溶液:
5NaNO2+2KMnO4 3H2SO4═2MnSO4+5NaNO3+K2SO4 3H2O
2MnO4- 5NO2- 6H+═2Mn2 5NO3- 3H2O
与量有关的离子方程式的书写技巧