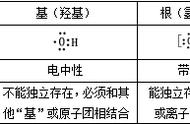
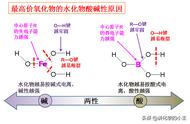
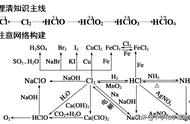
①实验甲中 a、b 两支试管中沉淀逐渐溶解,最终完全消失,对应的离子方程式分别为: Al(OH)3+3H +===Al3++3H2O、Al(OH)3+OH -===AlO - 2+2H2O。 由上述反应可知 Al(OH)3为两性氢氧化物。
②实验乙中 a 试管中沉淀溶解,b 试管中沉淀不溶解,a 试管中反应的离子方程式为:Mg(OH)2 +2H +===Mg 2++2H2O。
③由上述实验可知
钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为 NaOH>Mg(OH)2> Al(OH)3。
(3)钠、镁、铝的金属性由强到弱的顺序为 Na>Mg>Al。
2.硅、磷、硫、氯的非金属性的递变规律

3.同周期元素性质递变规律

同一周期从左到右,元素金属性逐渐减弱,非金属性逐渐增强。
例 1.元素原子得失电子的能力与原子的____(填序号)有关:
①质子数(核电荷数) ②中子数 ③质量数 ④核外电子数 ⑤最外层电子数 ⑥电子层 数
例 2.下列关于元素周期律的叙述中不正确的是( )
A.Na、Mg、Al 最外层电子数依次增多,其单核离子的氧化性依次增强
B.P、S、Cl 最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强
C.同周期元素的原子半径以第ⅦA 族的为最大
D.Na、Mg、Al 的氢氧化物的碱性依次减弱
例 3.在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号)。 (下同)
2)金属性最强的元素是________(填元素符号)。
(3)最高价氧化物对应水化物酸性最强的是__________(用化学式回答,下同)。
(4)最不稳定的气态氢化物是________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
未完,有需要的朋友,私信,免费送哦
,